
자폐증에 대한 줄기세포 치료의 계통적 고찰
자폐증에 대한 줄기세포 치료의 효과에 대해서는 최근 많은 연구가 이루어지고 있으며, 그 유효성과 안전성에 대한 관심이 높아지고 있습니다.이 기사에서는, 2022년에 Villarreal-Mart ínez 박사등에 의해 발표된, 자폐 스펙트럼증(ASD)에 대한 줄기세포 치료의 메타 해석과 계통적 리뷰에 대해 자세하게 알아봅니다.
이 메타 분석에서는 11건의 임상 시험이 검토되었습니다.이 시험들은 줄기세포 치료가 ASD 증상에 어떤 영향을 주는지 평가하고 있습니다.구체적으로는 ABC(Aberrant Behavior Checklist) 스케일과 CARS(Childhood Autism Rating Scale)를 이용하여 치료의 효과가 측정되었습니다.
ABC 스케일의 결과에서 치료군에서는 약 12점의 개선이 확인되었습니다.이는 자폐아의 이상 행동이 줄기세포 치료에 의해 현저히 개선되었음을 보여줍니다.또한 CARS 스케일에서는 약 9점의 개선이 확인되었습니다.CARS 스케일은 60점 만점이고 30점 이하면 자폐증이 아닌 것으로 진단되기 때문에 9점 개선은 매우 큰 의미를 갖습니다.
게다가 몇몇 임상 시험에서는 줄기세포 치료가 뇌의 대사나 신경 활동을 개선한다는 것이 보고되었습니다.이를 통해 자폐아의 인지 기능과 행동이 개선될 가능성이 시사되고 있습니다.
주목할 만한 것은 지금까지의 임상시험에서 심각한 유해현상이 하나도 보고되지 않았다는 것입니다.이것은 줄기세포 치료가 안전하다는 것을 보여줍니다.
이상의 것으로부터, 자폐 스펙트럼증에 대한 줄기세포 치료는, 안전하고, 증상의 개선에 유효하다는 것이 많은 임상 시험에서 나타나고 있습니다.앞으로 더 많은 연구가 이루어져 이 치료법이 널리 보급될 것으로 기대됩니다.
이처럼 자폐증에 대한 줄기세포 치료에 관한 최신 연구결과를 바탕으로 효과와 안전성에 대해 자세히 고찰하였습니다.관심 있으신 분들은 꼭 관련 문헌을 참조해 주세요
| Stem Cell Therapy in the Treatment of Patients With Autism Spectrum Disorder: a Systematic Review and Meta-analysis |

초록
목적 자폐증 환자에 대한 최근 줄기세포 치료의 안전성과 유효성을 특히 인지장애나 행동장애 측면에서 평가, 분석했다.
방법 자폐스펙트럼증에 대한 줄기세포요법에 대한 최근 대조시험과 비대조시험, 임의화시험, 비랜덤화시험에 대해 조사했다.데이터 소스로서 Scopus, Web of Science, MEDLINE, EMBASE를 이용했다.대조군이 없는 연구에 대한 바이어스 위험은 코크란과 NIH의 품질 평가법을 이용하여 평가하였다.
결과 총 461명의 환자를 포함한 11개의 임상시험이 본 해석 기준을 충족했다.ABC(Autism Behavior Checklist) 스케일에 대해 보고한 시험의 메타해석은 치료군의 평균점수는 -11.97(95% 신뢰구간 -91.45~ 67.52, p<0.01)였다. CARS(Childhood Autism Rating Scale) 스케일에 대해 보고한 시험의 메타해석은 치료군의 평균점수는 -9.08(95% 신뢰구간 -15.43~ -2.73, p<0.01)이었다.
VABS(Vineland Adaptive Behavior Scales) 스케일에 대해 보고한 시험은 각 항목별로 보고되었으며 커뮤니케이션 능력은 평균 2.69(95% 신뢰구간 1.30~ 4.08, p=0.92), 일상생활 능력은 1.99 (95% 신뢰구간 0.83~ 3.15, p=0.51), 운동능력은 1.06 (95% 신뢰구간 -0.37 ~ 2.48, p=0.20), 사회적 능력은 3.09 (95% 신뢰구간 1.71 ~ 4.48, p=0.61), 적응행동능력은 2.10 (95% 신뢰구간 1.04 ~ 3.16, p=0.36)였다.
그리고 가장 일반적인 부작용은 발열이나 과잉, 구토, 두통이었으며, 심각한 유해현상은 포함되어 있지 않았다. (※필자 코멘트 이러한 부작용은 주로 수공 내에 직접 투여하는 방법, 타인의 줄기세포(형제 포함), 배양한 줄기세포 투여에서 발생하고 있으며, 자신의 것을 배양하지 않고 투여하는 방법에서는 이러한 부작용이 확인되지 않았습니다.)
결론 일련의 임상시험으로부터 줄기세포 치료는 자폐 스펙트럼을 유의하게 개선한다는 것이 시사되었으며, 향후 연구는 추가적인 신뢰 확립에 기여할 것이다.그리고 지금까지 줄기세포 요법과 관련한 위중한 유해현상이 나타났다는 보고가 없다는 것도 부기한다.
| 여기에서 자폐증(자폐증 스펙트럼), 발달장애의 최신 치료, 중간엽계 골수혈모세포 이식 치료를 보실 수 있습니다. |
자폐증에 대한 줄기세포 치료의 계통적 고찰 본문

배경
자폐 스펙트럼증(ASD)은 일련의 복잡한 신경 발달 장애이다 [1]자폐증은 ASD 중에서도 가장 빈도가 높은 질환으로 생후 조기에 발병하여 사회적 의사소통 및 교류의 결여, 제한된 흥미, 반복적이고 상동적인 언어적 또는 비언어적인 행동으로 특징지어짐 [2]。
최근 조기진단법이나 행동요법은 진보했음에도 불구하고 효과적인 치료법은 확립되었다고는 말하기 어렵다[3, 4]. 현재의 치료법은 향정신성의약품, 행동요법, 작업요법, 언어요법, 전문적인 교육 및 직업지원을 들 수 있다[5, 6, 7, 8]. 그리고 ASD 환자에서 신경염증이나 신경회로의 이상 소견이 있는 경우 신경염증이나 신경회로를 제어하기 위한 치료적 개입이 유효하다는 결과가 보고되었다 [9]또한 최근 줄기세포 치료에 의해 ASD의 신경학적인 이상이 개선된 것이 여러가지 보고되고 있다 [9、10、11、12]。
지금까지의 동물실험의 연구로부터, 간엽계 줄기세포(Mesenchymal Stem Cells, MSC)는 신경에 대해, 보호적인 작용이나 신경신생작용, 시냅스 형성 촉진작용을 가져온다는 것을 알게 되었다[13, 14, 15, 16, 17 , 18 , 19]. 그리고 그러한 연구가 계기가 되어 ASD를 가진 아이들의 치료를 위해서 줄기세포의 이식이 행해지게 되었다[11 , 20 , 21 , 22 , 23].
지금까지 검토된 접근법에는 자기 골수에서 나온 단핵구(bone marrow monuclear cell, BMMC)의 이식이나 [21, 22], 타인 유래 혹은 자기의 제대혈에서 추출한 단핵구(cord blood monuclear cell, CBMNC)의 이식 또는 그것과 제대 유래의 MSC를 조합하여 이식하는 방법 [11, 23]이 보고되었다.또한 세포의 투여 경로로는 뇌수강 내 혹은 정맥 내 투여가 선택되어 왔다.
이들 연구결과는 대체로 일치하며, ASD의 행동이상이나 사회적 기술이나 언어장애, 뇌대사를 각각 개선하고 안전성에 대한 우려도 없다.그러나 한편으로 최적의 투여 경로나 세포의 종류, 조정 방법, 투여량에 대해 보다 우수한 치료 효과를 가져오려면 어떻게 해야 하는지 미지의 점도 많다.
그러한 배경으로부터, 이번에 우리는 지금까지의 줄기세포 치료의 안전성과 유효성 및 ASD의 인지 장해나 행동 장해에 대한 효과에 대해서, 계통적 리뷰와 메타 해석을 실시했다[11].
방법
연구 디자인
이 연구는 Preferred Reporting Items for Systematic review and Meta-Analysis(PRISMA)의 순서에 준한다. 또한 International Prospective Register of Systematic Reviews (PROSPERO)에 번호 CRD42021225190으로 등록되어 있다
임상 시험의 적합 기준
자폐 스펙트럼증의 치료법으로서 줄기세포 요법의 효과를 평가한 대조 시험이나 비대조 시험, 임의화 시험 및 비랜덤화 시험을 대상으로 했다.위약군과 비교한 시험뿐만 아니라 비교 대조 없이도 가능하도록 했다.주요 관심항목은 임상평가 척도의 개선이며, 부차 관심항목으로는 화상검사상의 변화와 유해현상을 포함시켰다.영어 이외의 언어를 사용한 연구는 제외했다.
문헌 검색 방법 및 데이터 관리
경험이 풍부한 사서(이니셜 E.G.L.)가 주임 연구자로부터의 정보를 바탕으로 검색 방법을 생각해, 본 연구에 참가한 연구자 전원의 승낙 하에 실시했다.Scopus, Web of Science, MEDLINE, EMBASE의 온라인 데이터베이스에 대해 그들의 기재 개시 연도부터 2020년 11월까지의 문헌을 검색했다.
더 놓쳤을 가능성이 있는 임상연구를 밝혀내기 위해 이 분야 전문가들에게도 상담하면서 문헌 검색을 했다.보충 정보란에 상세한 검색 방법을 기재했다(보충 A1、A2) . 문헌의 중복을 배제하기 위해 EndNote X8에 업로드하고, 거기에서 초록과 전문 양쪽 모두를 Distiller Systematic Review (DSR)에 업로드했다.
연구의 채용 과정
문헌에 기재된 연구를 채용할지의 심사 과정은 2단계로 나누었다.4명의 심사 담당자(이니셜 G.G.M., M.S.F., A.J.BG, A.GM)가 독자적으로 작업을 추천하고, 우리의 해석에 적합한지에 대해 하나의 문헌에 대해 두 사람이 평가했다.심사 담당자의 의견이 일치하는지 확인하는 데 카파 계수를 이용했다.우선 4명의 기준에 차이가 없는지를 확인하기 위해 심사 전 간단한 예비 테스트를 했고 카파 계수가 0.7 이상에 이를 때까지 테스트를 반복했다.
심사의 제1단계에서는 문헌의 제목과 요약만으로 각 담당자가 적합 기준에 근거해 연구를 심사, 취사선택했다.이 단계에서는 연구 소홀이 없도록 두 담당자 간 의견이 다를 경우 우선 다음 심사를 하기로 했다.심사의 제2 단계에서는, 문헌의 본문으로부터 적합성을 평가했다.이 단계에서 담당자 간에 의견이 다를 경우에는 논의를 통해 채용 여부를 결정했다.
데이터 수집 과정
채용된 각 연구에 대해 앞의 4명의 심사 담당자(G.G.M., M.S.F., A.J.BG, AGM) 중 2명이 각각 독립적으로 브라우저 기반의 수집 양식을 사용해 데이터를 수집했다.각 연구에 대해서, 연구 설정, 제목, 저자 정보, 출판년, 환자의 베이스라인 특성(연령, 성별, 인종, 병존질환), 치료방법과 유해사례 및 영상검사(있다면)와 치료 개선점에 대한 정보를 수집했다.
이 단계에서 담당자 두 사람이 수집한 정보에 차이가 있을 경우 두 사람의 대화 또는 다른 심사 담당자의 의견에 따라 정보를 일치시켰다.대조군을 마련한 연구에 대해서는 개입군(치료군)으로부터 환자 데이터만을 추출했다.
각 연구가 초래하는 편견의 위험
각 연구가 초래하는 바이어스 리스크에 대해 4명의 심사 담당자(G.G.M., M.S.F., A.J.BG, AGM) 중 2명이 각각 독립적으로 평가했다.비교 대상군을 둔 랜덤화 시험에서의 바이어스 리스크를 평가하기 위해 코크란 리스크 오브 바이어스 2.0(RoB2.0)을 이용했다.
이 수법은, (1) 무작위화의 과정으로부터 생기는 바이어스, (2) 의도한 개입으로부터의 일탈에 의한 바이어스, (3)전귀 데이터의 누락에 의한 바이어스, (4)결과의 측정에 있어서의 바이어스, (5)보고된 결과의 선택에 있어서의 바이어스, 라고 하는 5개의 포인트(도메인이라고 불린다)를 평가하는 것이다.
각 연구는 그 바이어스에 대해, 높다, 우려 있다, 낮다라는 3단계로 평가되었다.대상군이 없는 싱글암 시험에 대해서는 해당하는 NIH의 품질평가 툴을 사용했는데, 그것은 환자 특성이나 아웃컴, 개입 방법, 기타 방법론적인 특징에 대해 평가하는 것이다.이러한 연구의 품질은 양호, 보통, 나쁨의 3단계로 평가되었다. 담당자 간에 의견이 다른 경우에는 대화를 통해 의견을 일치시켰다.
데이터 작성 및 통계 분석
먼저 우리의 적합 기준을 충족한 연구를 글로 요약했다.가능한 경우는 PROSPERO에서 미리 정리한 결과를 이용해 줄기세포요법의 치료효과를 추정하기 위한 메타해석을 실시했다.하나의 시험에서 복수의 개입군이 존재하는 경우, 개입에 관한 계통적 리뷰의 코크란 핸드북 [24]에 따라 복수의 독립된 비교를 포함하기 위해 필요한 군으로 나누었다.
정량적인 데이터의 작성에 대해서는, 단일 평균의 랜덤 효과 메타분석이라고 불리는 수법을 이용해 전체 평균을 계산하는 것과 동시에, 역분산 가중법을 이용해 개입군에 있어서의 치료 전후의 스코어의 단일 평균을 집적해 갔다[25].또한 불균일성에 대해서는 코크란의 Q 테스트(p값 <0.10에 의해 결정되는 높은 불균일성) 및 값이 25% 이하인 경우를 낮은 불균일성으로 하고 75% 이상을 높은 불균일성으로 하는 I2 검정을 이용해 산출했다.
개입효과가 카테고리 변수인 경우 빈도로 하고, 연속변수인 경우 평균값 또는 중앙값을 산출했다.코크란 핸드북에 기재된 개입군을 통합하기 위한 식을 이용하여 각 시험의 평균값과 표준편차(SD)를 통합하였다.가능한 경우 R (버전 4.0) 와 R Studio (버전 1.2.5001)의 「메타」패키지를 사용해, 개변율을 계산하기 위한 일반화 선형 혼합 효과 모델을 사용한 변량 효과 메타해석을 실시했다.

결과
문헌의 검색 결과
합계 5,237건의 문헌이 온라인 데이터베이스로부터 발견되었다.프로토콜만의 것, 중복 참조, 적합 기준을 충족하지 않은 것 등을 제외한 결과, 11건의 연구가 본 해석의 대상이 되었다.이들은 대상군이 없는 싱글암 시험 또는 대조군이 있는 비교시험이었다.
연구의 특징
적합한 11건의 연구의 피험자에 대해 연령폭이 2세에서 33세, 인원수는 12명에서 180명, 추적기간은 6개월에서 26개월이었다.테이블 1에 그 개요를 나타낸다.투여된 줄기세포의 종류는 6개 연구에서는 자가 제대혈세포[9, 23, 26, 27, 28, 29], 3개 연구에서는 골수 단핵세포[11, 21, 30]로 나타났으며 한 연구에서는 중간엽계 간질세포의 정맥 내 주입이 이루어졌다.한 연구에서는 태아 유래 줄기세포 이식이 실시되었다[31].또 대부분의 연구는 줄기세포 치료의 유효성과 안전성에 대해 알아보는 것이 주 아웃컴이었다.
평가 척도
대상으로 한 문헌 전체에서는, 이하에 설명하는 14개의 평가 스케일(척도)이 이용되고 있었다.자폐증 진단 관찰 척도(Autism Diagnostic Observation Schedule, ADOS), 바인랜드 적응 행동 척도(Vineland Adaptive Behavior Scales, VABS), 자폐증 임상 전체 인상도(Autism Clinical Global Impression, CGI), 표현적 일어 화상 어휘 테스트(Expressive One-Word Picture Vocabulary Test, EOWPVT), 수용적 일어 화상 어휘 테스트(Receptive One-Word Picture Vocabulary Test, ROWP,ATEC), 소아 자폐증 평가 척도 (Childhood Autism Rating Scale, CARS), 자폐증 행동 체크리스트 (Autism Behavior Checklist, ABC), 인도 자폐증 평가 척도 (Indian Scale for Assessment of Autism, ISAA), 기능적 자립도 평가표 (Functional Independence Measure, FIM) , 어린이를 위한 기능적 자립도 평가법 (Wee Functional Independence Measure , WeeFIM) , 광범성 발달장애 행동 인벤토리 (Pervasive,발달지수(Development Quotient, DQ) 및 스탠포드-비네 지능 스케일(Stanford Binet)이다.메타해석은 2개 이상의 논문에서 보고된 ABC 스케일, CARS 스케일, VABS 스케일의 3개의 평가 스케일에 대해 실시했다.
ABC스케일
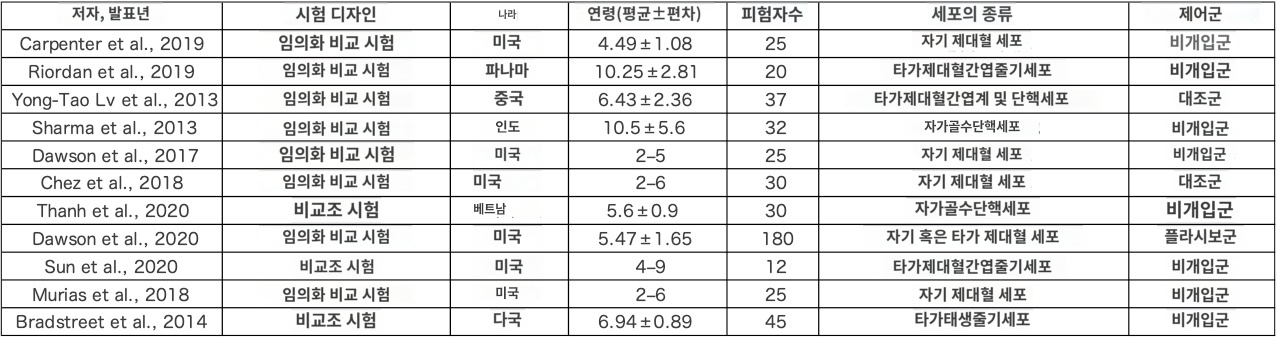
두 연구는 ABC 스케일에서 치료 효과를 보고했다 [11、31] 。메타해석의 결과, 개입군의 평균값은 마이너스 11.97점이었다(95% 신뢰 구간 -91.45 ~ 67.52, I2 = 99%, p<0.01, 그림 2).
CARS 스케일
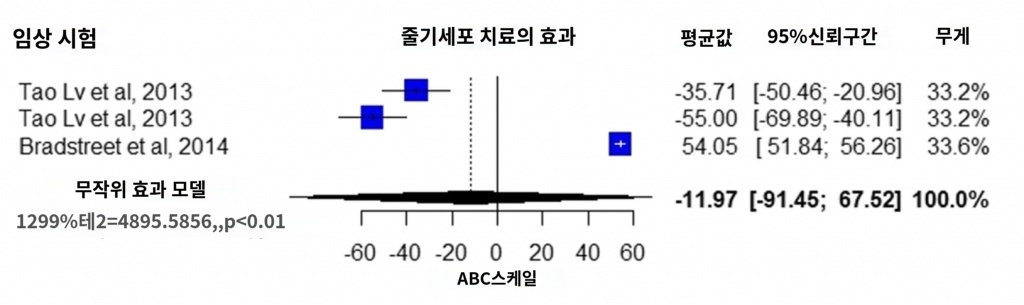
3개의 연구에서는 CARS 스케일로 치료 효과가 보고되고 있다[11, 26, 30]. 메타해석의 결과, 개입군의 평균값은 마이너스 9.08점이었다(95% 신뢰 구간 -15.43 ~ -2.73, I2 = 88%, p<0.01 , 그림 3).
VABS 스케일
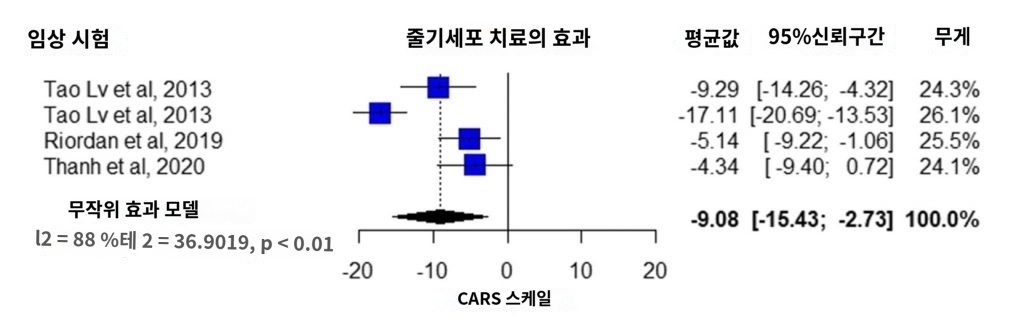
4개의 연구에서는 VABS 스케일, 커뮤니케이션 영역에서의 치료 효과가 보고되었다 [23、27、28、30] 。 메타분석 결과 개입군의 평균값은 2.69점이었다(95% 신뢰구간 1.30 ~ 4.08、I2 = 0%, p = 0.92, 그림 4a).VABS 스케일의 일상생활 영역은 4개의 연구에서 보고되었으며 [23, 27, 28, 30], 메타해석 결과, 개입군의 평균값 1.99점이었다(95% 신뢰구간 0.83 ~ 3.15、I2 = 0%, p = 0.51, 그림 4b). 운동 도메인은 4개의 연구에서 보고되었으며[23, 27, 28, 30], 메타해석 결과, 평균치 1.06점이었다(95% 신뢰구간 -0.37~ 2.48, I2 = 28%, p = 0.20, 그림 4c). 사회적 영역은 3개의 연구에서 보고되었으며[23, 28, 30], 메타해석 결과, 개입군의 평균값은 3.09점이었다(95% 신뢰구간 1.71 ~ 4.48、I2 = 0%, p = 0.61, 그림 4d). 적응행동능력은 3개의 연구에서 보고되었으며[23, 27, 28], 메타해석 결과, 개입군의 평균값은 2.10점이었다(95% 신뢰구간 1.04〜3.16、I2 = 9%, p = 0.36, 그림 4e).
유해 현상
줄기세포 치료의 유해현상(부작용)을 보고한 5개의 연구를 대상으로 비율 메타분석을 실시했다.4개 연구에서는 발열이 31%(p=0.02, I2=61%), 3개 연구에서 두통이 13%(p)였다 = <0.001, I2=78.6%), 4개 연구에서는 구토가 25%(p = <0.001, I2 = 72%), 또 3개의 연구에서는 과잉행동이 27%(p = 0.07, I2 = 46.3%), 3개의 연구에서는 공격성이 14%(p = 0.39, I2 = 0.0%), 각각 보고되었다.
영상 검사
6개의 연구에서는 화상 진단 결과가 보고되었다.한 연구에서는 MRI를 사용해 자폐증 병태와 이전부터 관련되어 있던 대뇌 변연계나 전두엽, 측두엽 및 대뇌 기저핵의 신경회로 접속 증가와 행동 개선이 관련되었다 [9] 。다른 연구에서는 8명의 환자에게 PET-CT 스캔을 사용하여, 세포요법 후 당 흡수의 증가가 6명의 환자에서는 전두엽과 두정엽, 5명의 환자에서는 후두엽과 측두엽, 4명의 환자에서는 소뇌.
3명의 환자에서는 편도체, 해마, 해마방에서도, 추가로 5명의 환자에서는 대상회, 대상회야, 대뇌 기저핵에서 관찰되었다.한편 개입 전 PET-CT 스캔에서는 전두엽, 소뇌, 편도체, 해마, 해마방 및 내측 측두엽 영역에서 FDG 도입의 감소가 나타남과 동시에, 개입 후 6개월 후에도 이와 같은 영역에서의 당 섭취 증가가 확인되었다 [21] 。
또 다른 연구에서는 뇌파검사(EEG)가 진행되어 특정 양측 전두엽 우세한 전반성 또는 국소적인 스파이크파 활동이 측두정 중앙 영역에서 확인되었다[27]. 또 다른 연구에서도 EEG를 사용하여 치료 그룹 간의 주효과를 밝혀냈다[28]. 또 다른 연구 그럼 세포치료 12개월 후의 EEG 스펙트럼 특성 정규화에 반영되는 EEG 파워의 현저한 변화가 나타났다[29].
치료 전 EEG 베타2 파워가 높을수록 사회적 의사소통 증상의 개선 정도가 높고, 더 나아가 EEG 베타2 파워와 NVIQ의 기준선 측정치를 조합하면 치료 반응을 고도로 예측할 수 있어 EEG의 유용성이 시사되었다[29].PET 스캔을 사용한 연구에서는 통계적으로 유의하지 않았지만 치료 전 대사가 저하되었던 두정엽, 전두엽, 전대상회의 영역이 치료 후에는 그 대사가 개선되고 있었다[30].
바이어스 위험
코크란 리스크 오브 바이어스를 사용하여 세 가지 연구를 평가한 바, 바이어스 위험이 낮은 연구[11]와 함께 어떤 우려가 있는 연구 [27]이나 편견의 위험이 높은 연구 [28]이 있음이 판명되었다.후자 두 연구에 대해 모두 당초 계획된 개입으로부터의 일탈이 있었으며, 고위험으로 분류된 마지막 연구는 더 나아가 피험자의 임의화 할당 과정에 대한 우려가 발견되었다.
또한 NIH의 품질 평가 툴을 사용하여 8가지 연구 [5, 9, 21, 23, 26, 29, 30, 31]을 평가한 결과, 6개의 연구 [5, 9, 21, 23, 26, 29]는 보통, 2개의 연구[30, 31]는 양호했다.
고찰
주요 결과
이번 계통적 리뷰는 자폐증에 대한 줄기세포 치료의 최근 임상시험 결과를 요약한 것으로, 일련의 연구를 통해 줄기세포 치료가 자폐 스펙트럼증의 평가 점수를 크게 개선할 것임을 시사하는 것으로 보인다.보고된 유해사례에는 발열, 활동항진, 구토, 두통, 공격성이 있지만 심각한 것은 아니다.
또 하나 밝혀진 중요한 발견은 영상검사상의 개선이며, 한 연구에서는 MRI 상에서의 신경활동 증가와 함께 PET-CT를 사용한 두 연구에서는 줄기세포 치료 후 뇌의 대사 개선이 나타났으며, EEG를 사용한 세 연구에서 치료 반응의 예측 가능성에 대해 제기되었다.
결론
줄기세포요법을 포함한 재생의료는 치료법의 선택이 없는 질병을 고치기 위해 연구가 진행되고 있다.자폐증에 대해서도 근치요법이 없어 치료의 선택지는 한정되어 있다.이번 연구에서는 자폐 스펙트럼증에 대한 줄기세포 치료의 안전성과 유효성을 살펴본 최근 임상시험을 메타분석했다.과거의 연구와 비교해도 가장 포괄적인 조사이다.
줄기세포 치료와 관련된 심각한 유해사례는 없으며, 최근 일련의 연구결과는 세포의 출처, 투여량, 투여경로에 관계없이 줄기세포 치료가 자폐 스펙트럼 개선에 효과적임을 보여준다.이번 결과는 환자나 임상의사들이 많은 정보를 바탕으로 하는데 있어서도 줄기세포 치료가 효과적이고 위험이 적다는 것을 이해하는 데 도움이 될 것이다.

참고문헌
Theoharides, T. C., Kempuraj, D., & Redwood, L. (2009). Autism: an emerging “neuroimmune disorder” in search of therapy. In Expert Opinion on Pharmacotherapy(Vol. 10, Issue 13, pp. 2127–2143). https://doi-org.osaka-u.idm.oclc.org/10.1517/14656560903107789
American Psychiatric Association. (2013). Diagnostic and Statistical Manual of Mental Disorders (DSM-5®). American Psychiatric Pub
Siniscalco, D., Kannan, S., Semprún-Hernández, N., Eshraghi, A. A., Brigida, A. L., & Antonucci, N. (2018). Stem cell therapy in autism: recent insights. In Stem Cells and Cloning: Advances and Applications (Vol. 11, pp. 55–67). https://doi-org.osaka-u.idm.oclc.org/10.2147/sccaa.s155410
de Magistris, L., de Magistris, L., Picardi, A., Siniscalco, D., Riccio, M. P., Sapone, A. … Bravaccio, C. (2013). Antibodies against food antigens in patients with autistic spectrum disorders. In BioMed Research International (Vol. 2013, pp. 1–11). https://doi-org.osaka-u.idm.oclc.org/10.1155/2013/729349
Sun, J. M., Dawson, G., Franz, L., Howard, J., McLaughlin, C., Kistler, B. … Kurtzberg, J. (2020). Infusion of human umbilical cord tissue mesenchymal stromal cells in children with autism spectrum disorder. In STEM CELLS Translational Medicine (Vol. 9, Issue 10, pp. 1137–1146). https://doi-org.osaka-u.idm.oclc.org/10.1002/sctm.19-0434
Payakachat, N., Tilford, M., Kovacs, J., & Kuhlthau, K. (2012). Autism spectrum disorders: a review of measures for clinical, health services and cost–effectiveness applications. Expert Review of Pharmacoeconomics & Outcomes Research, 12(Issue 4), 485–503. https://doi-org.osaka-u.idm.oclc.org/10.1586/erp.12.29
Ellison-Wright, Z., & Boardman, C. (2015). Diagnosis and management of ASD in children and adolescents. Progress in Neurology and Psychiatry, 19(6), 28–32
Nevels, R. M., Dehon, E. E., Alexander, K., & Gontkovsky, S. T. (2010). Psychopharmacology of aggression in children and adolescents with primary neuropsychiatric disorders: a review of current and potentially promising treatment options. Experimental and Clinical Psychopharmacology, 18(2), 184–201
Carpenter, K. L. H., Major, S., Tallman, C., Chen, L. W., Franz, L., Sun, J. … Dawson, G. (2019). White matter tract changes associated with clinical improvement in an open-label trial assessing autologous umbilical cord blood for treatment of young children with autism. In STEM CELLS Translational Medicine (Vol. 8, Issue 2, pp. 138–147). https://doi-org.osaka-u.idm.oclc.org/10.1002/sctm.18-0251
Boncoraglio, G. B., Ranieri, M., Bersano, A., Parati, E. A., & Del Giovane, C. (2019). Stem cell transplantation for ischemic stroke. Cochrane Database of Systematic Reviews, 5, CD007231
Lv, Y. T., Zhang, Y., Liu, M., Qiuwaxi, J. N. T., Ashwood, P., Cho, S. C. … Hu, X. (2013). Transplantation of human cord blood mononuclear cells and umbilical cord-derived mesenchymal stem cells in autism. Journal of Translational Medicine, 11, 196
Nguyen, L. T., Nguyen, A. T., Vu, C. D., Ngo, D. V., & Bui, A. V. (2017). Outcomes of autologous bone marrow mononuclear cells for cerebral palsy: an open label uncontrolled clinical trial. BMC Pediatrics, 17(1), 104
Spejo, A. B., Carvalho, J. L., Goes, A. M., & Oliveira, A. L. R. (2013). Neuroprotective effects of mesenchymal stem cells on spinal motoneurons following ventral root axotomy: synapse stability and axonal regeneration. Neuroscience, 250, 715–732
Ziv, Y., Finkelstein, A., Geffen, Y., Kipnis, J., Smirnov, I., Shpilman, S. … Yoles, E. (2007). A novel immune-based therapy for stroke induces neuroprotection and supports neurogenesis. Stroke; a Journal of Cerebral Circulation, 38(2 Suppl), 774–782
Shen, L. H., Li, Y., Chen, J., Zacharek, A., Gao, Q., Kapke, A. … Chopp, M. (2007). Therapeutic benefit of bone marrow stromal cells administered 1 month after stroke. Journal of Cerebral Blood Flow and Metabolism: Official Journal of the International Society of Cerebral Blood Flow and Metabolism, 27(1), 6–13
McTighe, S. M., Neal, S. J., Lin, Q., Hughes, Z. A., & Smith, D. G. (2013). The BTBR mouse model of autism spectrum disorders has learning and attentional impairments and alterations in acetylcholine and kynurenic acid in prefrontal cortex. PLoS One, 8(4), e62189
Segal-Gavish, H., Karvat, G., Barak, N., Barzilay, R., Ganz, J., Edry, L., & Kimchi, T. (2016). Mesenchymal stem cell transplantation promotes neurogenesis and ameliorates autism related behaviors in BTBR Mice. Autism Research: Official Journal of the International Society for Autism Research, 9(1), 17–32
Perets, N., Segal-Gavish, H., Gothelf, Y., Barzilay, R., Barhum, Y., Abramov, N. … Offen, D. (2017). Long term beneficial effect of neurotrophic factors-secreting mesenchymal stem cells transplantation in the BTBR mouse model of autism. Behavioural Brain Research, 331, 254–260
Ha, S., Park, H., Mahmood, U., Ra, J. C., Suh, Y. H., & Chang, K. A. (2017). Human adipose-derived stem cells ameliorate repetitive behavior, social deficit and anxiety in a VPA-induced autism mouse model. In Behavioural Brain Research (Vol. 317, pp. 479–484). https://doi-org.osaka-u.idm.oclc.org/10.1016/j.bbr.2016.10.004
Price, J. (2020). Cell therapy approaches to autism: a review of clinical trial data. Molecular Autism, 11(1), 37
Sharma, A., Gokulchandran, N., Sane, H., Nagrajan, A., Paranjape, A., Kulkarni, P. … Badhe, P. (2013). Autologous bone marrow mononuclear cell therapy for autism: an open label proof of concept study. Stem Cells International, 2013, 623875
Bansal, H., Verma, P., Agrawal, A., Leon, J., Sundell, I. B., & Koka, P. S. (2016). A short study report on bone marrow aspirate concentrate cell therapy in ten South Asian Indian patients with autism. Journal of Stem Cells, 11(1), 25–36
Dawson, G., Sun, J. M., Davlantis, K. S., Murias, M., Franz, L., Troy, J., & Kurtzberg, J. (2017). Autologous cord blood infusions are safe and feasible in young children with autism spectrum disorder: results of a single-center phase i open-label Trial. Stem Cells Translational Medicine, 6(5), 1332–1339
Higgins, J. P. T., & Thomas, J. (2019). Cochrane Handbook for Systematic Reviews of Interventions. Wiley
Balduzzi, S., Rücker, G., & Schwarzer, G. (2019). How to perform a meta-analysis with R: A practical tutorial. Evidence-Based Mental Health, 22(4), 153–160. https://doi-org.osaka-u.idm.oclc.org/10.1136/ebmental-2019-300117
Riordan, N. H., Hincapié, M. L., Morales, I., Fernández, G., Allen, N., Leu, C., & Novarro, N. (2019). Allogeneic human umbilical cord mesenchymal stem cells for the treatment of autism spectrum disorder in children: safety profile and effect on cytokine levels. Stem Cells Translational Medicine, 8(10), 1008–1016
Chez, M., Lepage, C., Parise, C., Dang-Chu, A., Hankins, A., & Carroll, M. (2018). Safety and observations from a placebo-controlled, crossover study to assess use of autologous umbilical cord blood stem cells to improve symptoms in children with autism. Stem Cells Translational Medicine, 7(4), 333–341
Dawson, G., Sun, J. M., Baker, J., Carpenter, K., Compton, S., Deaver, M., Franz,L., Heilbron, N., Herold, B., Horrigan, J., Howard, J., Kosinski, A., Major, S., Murias,M., Page, K., Prasad, V. K., Sabatos-DeVito, M., Sanfilippo, F., Sikich, L., … Kurtzberg,J. (2020). A Phase II Randomized Clinical Trial of the Safety and Efficacy of Intravenous Umbilical Cord Blood Infusion for Treatment of Children with Autism Spectrum Disorder. The Journal of Pediatrics, 222, 164–173.e5
Murias, M., Major, S., Compton, S., Buttinger, J., Sun, J. M., Kurtzberg, J., & Dawson, G. (2018). Electrophysiological biomarkers predict clinical improvement in an open-label trial assessing efficacy of autologous umbilical cord blood for treatment of autism. In STEM CELLS Translational Medicine (Vol. 7, Issue 11, pp. 783–791). https://doi-org.osaka-u.idm.oclc.org/10.1002/sctm.18-0090
Nguyen Thanh, L., Nguyen, H. P., Ngo, M. D., Bui, V. A., Dam, P. T. M., Bui, H. T. P. … Heke, M. (2021). Outcomes of bone marrow mononuclear cell transplantation combined with interventional education for autism spectrum disorder. Stem Cells Translational Medicine, 10(1), 14–26
Bradstreet, J. J., Sych, N., Antonucci, N., Klunnik, M., Ivankova, O., Matyashchuk, I. … Siniscalco, D. (2014). Efficacy of fetal stem cell transplantation in autism spectrum disorders: an open-labeled pilot study. Cell Transplantation, 23(Suppl 1), S105–S112
| 【면책 사항】 ※저희 사이트의 내용은 정보제공를 목적으로 게재하고 있습니다. ※번역 내용이나 치료를 특정인에게 권장하거나 보증하는 것은 아닙니다. ※자원봉사 번역 및 자동번역에 의한 오역으로 발생한 결과에 대해 일절 책임을 지지 않습니다. ※본인의 질환에 적용되는지 여부는 반드시 주치의와 상의하시기 바랍니다. |
의료기관 정보 문의
010 9002 7406
| 줄기세포 홈으로 가기 |
'줄기세포' 카테고리의 다른 글
| 신경장애 왜 골수유래 줄기세포 치료가 최적인가 (1) | 2024.07.06 |
|---|---|
| 혈연관계는 없는 HLA 부분 일치 기증자로부터의 조혈모세포 이식, 치료 성적은? (1) | 2024.06.11 |
| 뇌성마비에 대한 최근 줄기세포 치료,전종 줄기세포 16회 투여로 뇌성마비 사례 보고 (5) | 2024.06.07 |
| 파킨슨병 집속초음파 치료 FUS (1) | 2024.05.14 |
| 파킨슨병 줄기세포 치료 일본 (1) | 2024.03.28 |



